«В рамках XV Международного конгресса Российского общества онкоурологов состоялся сателлитный симпозиум компании «Байер» «Современный взгляд на проблему КРРПЖ: от клинических исследований к реальной практике». В симпозиуме участвовали ведущие российские онкоурологи. Эксперты обсудили результаты исследований новых препаратов для лечения КРРПЖ и индивидуализацию плана лечения заболевания.
«Метастатический кастрационно-резистентный рак предстательной железы (мкРРПЖ): выбор метода лечения во второй линии терапии с точки зрения эффективности и безопасности

доктор медицинских наук, член-корреспондент РАН, профессор, заместитель директора по научной и инновационной работе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Российского общества онкоурологов (Москва)
В начале доклада В.Б. Матвеев отметил, что при распространенных стадиях РПЖ основная проблема для пациентов – болевой синдром, возникающий при метастазировании в кости. Висцеральные метастазы встречаются реже, чаще всего в легких и печени.
В 90% случаев метастазами поражаются кости: либо только они, либо в сочетании с метастазами в лимфоузлы и висцеральные органы. Костные метастазы не только резко ухудшают качество жизни пациентов, но и снижают общую выживаемость (ОВ). Среди пациентов с костными метастазами только 3% доживают до пятилетнего наблюдения.
Для лечения мКРРПЖ у врачей имеются различные опции: андрогены нового поколения, цитотоксическая химиотерапия (ХТ) – доцетаксел и кабазитаксел. И уже несколько лет в клинической практике для лечения пациентов с КРРПЖ и метастазами в кости применяется радиофармпрепарат радий-223, который представляет собой альфа-эмиттер. По своей структуре радий-223 близок к кальцию, поэтому активно накапливается в костной ткани и включается в структуру поврежденной метастазами костной ткани.
Радий-223 – источник альфа-частиц высокой энергии, характеризующихся коротким излучением, поэтому препарат таргетно воздействует на клетки метастазов с минимальным воздействием на костный мозг. Это отличает препарат от бетаэмиттеров, влияющих на состояние костного мозга. Как правило, после применения бета-эмиттеров проведение цитотоксической ХТ уже невозможно. Одно из преимуществ радия-223 заключается в возникновении летальных невосстанавливаемых двухцепочечных разрывов ДНК в пораженных опухолевых клетках.
Докладчик отметил, что бета-частицы, помимо большей токсичности, вызывают одноцепочечные разрывы ДНК, которые не являются летальными. Возможно, поэтому бета-эмиттеры не улучшают показатели выживаемости. Альфа-частицы, напротив, вызывают необратимые изменения в опухолевой клетке.
Зарегистрировать радий-223 для лечения КРРПЖ с метастазами в кости позволило исследование III фазы ALSYMPCA. В нем участвовали пациенты с костными метастазами, но без висцеральных метастазов. Больные получали радий-223 в дозировке 50 кБк/кг один раз в четыре недели, было запланировано максимально шесть введений. Эта группа больных сравнивалась с пациентами, которые получали плацебо. Первичная цель – оценка ОВ, вторичные точки – время до повышения щелочной фосфатазы (ЩФ), ответ ЩФ, время до первого костного осложнения, время до нормализации ЩФ, время до повышения ПСА, безопасность и качество жизни. Допускалось включение пациентов, которые получали ХТ доцетакселом, а также пациентов со статусом ECOG больше 2. По градации болевого синдрома включались как пациенты с болью легкой степени тяжести, так и с болью тяжелой степени, которая требует приема неопиоидных или сильных опиоидных анальгетиков. По распространенности заболевания пациенты стратифицированы на больных с менее чем шестью метастазами, имеющих от шести до 20 и более 20 метастазов, а также на больных с тотальным поражением скелета (superscan). Разрешалось проведение лучевой терапии в течение последних 12 месяцев наблюдения.
Профессор Матвеев подчеркнул, что радий-223 – первый и пока единственный радиофармпрепарат, не просто оказывающий паллиативный эффект, уменьшая болевой синдром, но и увеличивающий ОВ пациентов.
Исследование показало снижение риска смерти при РПЖ на 30% по сравнению с пациентами, которые не получали радий-223. Поданализ подгрупп пациентов показал, что практически во всех группах пациенты получали выгоду от лечения радием-223. У больных с маленьким числом метастазов эта польза выражена меньше, чем у пациентов с большим числом. У больных, ранее получавших доцетаксел, также было показано преимущество показателя ОВ в группе радия-223. Таким образом, предшествующее применение доцетаксела не влияло на эффективность радия-223.
Преимущество ОВ было особенно выражено у пациентов, получивших пять и более инъекций радия-223. Медиана ОВ составила 17,9 месяца, а у пациентов, которые получили менее пяти введений, медиана выживаемости существенно ниже – только 6,2 месяца.
Снижение ЩФ к 12-й неделе терапии – предиктор эффективности лечения и увеличения ОВ. У тех, у кого отмечалось снижение ЩФ к 12-й неделе, выживаемость выше – медиана составила 17,8 месяца по сравнению с 10,4 месяца у пациентов без снижения ЩФ.
В исследовании ALSYMPCA отмечено увеличение времени до первого костного осложнения: у пациентов, получавших радий, на шесть месяцев увеличивается время до появления первого костного осложнения, которое было определено необходимостью применения лучевой терапии либо хирургической операции. Радий-223 увеличил время до первого костного осложнения во всех группах пациентов: у тех, кто получал доцетаксел, у тех, кто не получал его, и вне зависимости от параллельного применения остеомодифицирующих агентов, которое было разрешено продолжать, если пациент получал их до включения в протокол.
Применение препарата радий-223 также показало увеличение времени до повышения уровня ЩФ: медиана в два раза выше у пациентов, получавших радий, – 7,4 против 3,8 месяца в группе плацебо. Время до начала биохимической прогрессии также было достоверно выше в группе больных, получавших радий-223.
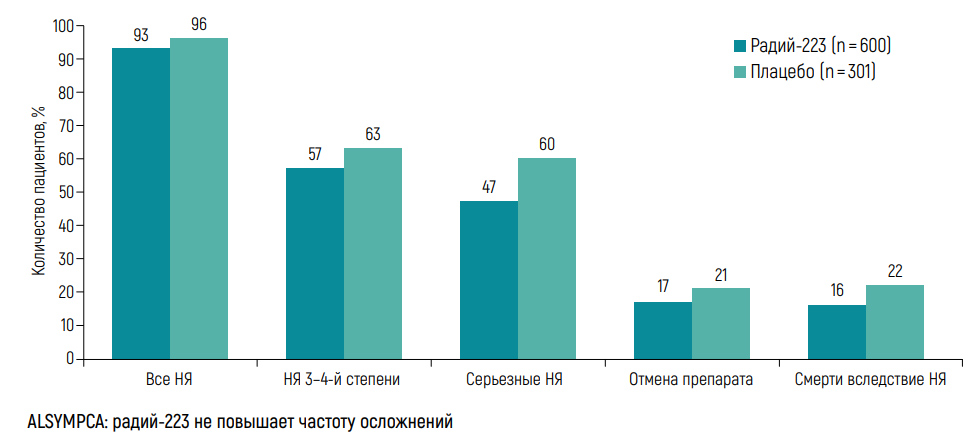
Таким образом, по вторичным конечным точкам исследования ALSYMPCA отмечено достоверное преимущество в группе пациентов, получавших радий-223. При этом число осложнений в этой группе пациентов было идентично нежелательным явлениям (НЯ), которые наблюдались у пациентов, получавших плацебо, – разница небольшая. Отмена препарата потребовалась у 17% больных в группе радия и у 21% больных в группе плацебо, следовательно, токсичность не является причиной отмены препарата.
Выступающий отметил, что радий-223 незначительно увеличивает гастроинтестинальные осложнения, что также является очень хорошим результатом: в сравнении с плацебо нет практически никакого различия. Гематологическая токсичность радия-223 тоже оказалась низкой: по анемии никакого различия, а по тромбоцитопении и нейтропении наблюдалось небольшое увеличение осложнений при применении радия, но процент низкий – 5% нейтропении и 12% тромбоцитопении. Среднее изменение баллов по результатам заполнения опросников FACT-P от базового уровня до 16-й недели терапии в группе пациентов, которые получали радий-223, составило -2,7, а в группе плацебо -6,8. Таким образом, радий-223 оказывает положительное влияние на показатель качества жизни. 23% пациентов в группе радия и 21% в группе плацебо получили ХТ уже после завершения исследования ALSYMPCA. Это говорит о том, что проведение терапии радием-223 не отрезает пути для проведения цитотоксической ХТ, состояние костного мозга после терапии радем-223 у больных было вполне хорошим. Гематологические показатели при проведении ХТ в отношении лейкоцитов, тромбоцитов и гемоглобина показали несущественное отличие между группами пациентов, получавших ранее радий-223 и плацебо.
Таким образом, у пациентов с КРРПЖ с метастазами в кости в первой линии терапии и после доцетаксела радий-223 показал достоверное преимущество ОВ в 3,6 месяца, увеличение времени до первого костного осложнения на 5,8 месяца, увеличение времени до ПСА-прогрессирования на 0,2 месяца, увеличение времени до повышения ЩФ как предиктора выживаемости и прогрессирования на 3,6 месяца.
Препарат хорошо переносится больными и улучшает качество их жизни. По шкале клинических преимуществ ESMO, оценивающей методы лечения на основе ОВ, безопасности и качества жизни, среди препаратов для лечения КРРПЖ радий-223 – единственный препарат, который получил наивысшую оценку 5 баллов.
Профессор Матвеев заявил, что в эпоху пандемии COVID-19 важно прибегать к методам лечения, избегающим токсичности. При лечении КРРПЖ применение радия-223 не вызывает осложнений в отличие от цитотоксической ХТ и потому предпочтительно.
Но возникает вопрос: когда проводить лечение радием-223 – во второй или в третьей линии терапии, уже после двух линий терапии КРРПЖ? Вопрос непростой, потому что опций лечения много. В.Б. Матвеев обратил внимание на то, что ограничение к проведению терапии радием-223 – появление висцеральных метастазов. Они развиваются по мере прогрессирования заболевания, причем значительно позже, чем костные. Но терапевтическое окно для назначения радия-223 небольшое. И если ждать слишком долго, то у пациента появляются висцеральные метастазы, и в этом случае больной лишается дополнительной опции лечения. В.Б. Матвеев считает, что раннее назначение радия-223 – во второй линии терапии – вполне оправданно.
Подводя итог докладу, специалист напомнил, что диссеминированный рак простаты составляет 20% от всех впервые выявленных случаев. Практически все пациенты с костными метастазами страдают от болевого синдрома, и рано или поздно все пациенты переходят в стадию кастрационной рефрактерности. В.Б. Матвеев заявил, что радий-223 – единственный безопасный радиофармпрепарат для пациентов с мКРРПЖ, который позволяет добиться максимального выигрыша ОВ у больных с шестью и более костными метастазами без висцеральных. Радий-223 следует назначать скорее раньше, чем позже. Для достижения максимального выигрыша от назначения радия-223 необходимо проведение пяти и более циклов терапии, что возможно при использовании препарата скорее во второй, чем в третьей линии, когда состояние больных значительно хуже. Терапия радием не ухудшает переносимость ХТ в дальнейшем.
Метастатический кастрационно-резистентный рак предстательной железы: настоящее и будущее радиофармтерапии. Результаты исследований в реальной клинической практике

доктор медицинских наук, профессор, заместитель генерального директора по научной работе ФГБУ «НМИЦ радиологии» Минздрава России, ученый секретарь Российского общества онкоурологов (Москва)
Профессор Б.Я. Алексеев рассказал о нескольких крупных исследованиях в реальной клинической практике. Один из этих протоколов iEAP – это 696 больных, получавших в реальной клинической практике препарат Ксофиго® (радий-223) в стандартном режиме. Отличие группы больных в этом наблюдательном исследовании от исследования ALSYMPCA в том, что в нее включались пациенты с бессимптомным течением КРРПЖ (20%). Больные могли получать до радия не только доцетаксел, но и препараты с антиандрогенной активностью – абиратерон и энзалутамид (когда было включение больных в исследование ALSYMPCA, эти препараты еще не использовались в рутинной практике). Также были пациенты, которые одновременно с участием в исследовании могли принимать абиратерон (40%), энзалутамид (8%) и деносумаб.
Профессор сообщил, что в реальной клинической практике медиана ОВ даже несколько выше по сравнению с исследованием ALSYMPCA (16 и 14,9 месяца). Медиана времени до роста ЩФ составила восемь месяцев, при том что этот маркер лучше, чем ПСА, отражает эффективность радионуклидной терапии радием-223. У 47% больных, то есть почти у половины, уровень ЩФ через три месяца лечения снижался более чем на 30%, а у 24%, то есть у каждого четвертого пациента, более чем на 50%.
Специалист отметил, что наибольшую выгоду от радионуклидной терапии радием-223 получили больные с хорошим функциональным статусом: чем лучше статус, тем выше эффективность лечения и тем дольше выживаемость. Больные с отсутствием болевого синдрома показали аналогичные результаты.
Наблюдательное исследование iEAP показало, что большее число инъекций препарата (пять или шесть) ведет к значительному увеличению продолжительности жизни больных по сравнению с теми пациентами, которые получили от одного до четырех введений препарата. Говоря о токсичности лечения, профессор сообщил, что больше всего проблем доставляет тромбоцитопения. Исследование iEAP показало, что при использовании радия-223 тромбоцитопения любой степени тяжести наблюдалась менее чем у 10% пациентов, при этом тромбоцитопения 3-й степени – у 2%, 4-й степени – у 1% больных (у 7 пациентов). Анемия 3-й степени наблюдалась у 12% пациентов, 4-й степени – 0. Нейтропения 3-й степени – у 2%, 4-й степени – менее чем у 1%. Другие НЯ 3-й степени встречались очень редко, что еще раз подтвердило хорошую переносимость радия-223 в реальной клинической практике.
Таким образом, этот протокол подтвердил результаты регистрационного исследования по эффективности и безопасности радия-223 и продемонстрировал, что наилучшие результаты можно получить у больных со слабовыраженным болевым синдромом или отсутствием такового и с хорошим соматическим статусом. И чем больше введений радия-223 получает пациент, тем лучше результаты терапии.
Профессор Б.Я. Алексеев рассказал также о REASSURE – международном обсервационном исследовании применения радия-223 у больных мКРРПЖ. В нем основными конечными точками были не только супрессия костного мозга и профиль безопасности при кратковременном и длительном применении радия-223, но и частота выявления вторичного онкологического процесса. Последняя – особенно интересная конечная точка, потому что системная радионуклидная терапия теоретически может способствовать развитию вторичных опухолей других локализаций.
По безопасности применения радия НЯ оценены у 1465 больных. При этом меньше чем у половины (48%) больных наблюдались любые НЯ, но 3-я степень выявлена только у 11% пациентов, а побочные эффекты, которые привели к отмене лечения радием-223, зарегистрированы лишь у 6% пациентов. Из всех НЯ выявлены только диарея (11%), тошнота (9%) и анемия (8%) – ни нейтропении, ни тромбоцитопении в лидирующих позициях не было. То есть это действительно первый препарат, обладающий такой низкой гематологической токсичностью. В этом протоколе больные до начала терапии радием получали абиратерон (45%), доцетаксел (38%), энзалутамид (35%), даже кабазитаксел (9%), то есть две линии ХТ. Сопутствующую терапию больные могли получать не только до применения радия, но и в комбинации с радием: 17% – энзалутамид, 15% – абиратерон и остеомодифицирующие агенты – бисфосфонаты и деносумаб. После терапии радием 14% больных получили доцетаксел, 11% – энзалутамид, 8% – абиратерон, 8% – кабазитаксел. Результаты показали, что радий абсолютно не исключает возможности для последующей цитотоксической ХТ и после применения радия можно спокойно провести даже две линии ХТ.
Медиана ОВ в этом наблюдательном исследовании составила 15,5 месяца, то есть была не хуже, а даже несколько выше, чем в исследовании ALSYMPCA. И только у 14 больных (1%) выявлены вторичные опухолевые очаги, при этом 71% (10 из 14) ранее получали дистанционную лучевую терапию, поэтому возможная причина развития этих опухолей – не радионуклидная терапия. Профессор заявил, что по результатам исследования можно сделать вывод: лечение радием-223 не приводит к риску развития вторичного онкологического процесса, и в реальной клинической практике супрессии спинного мозга и переломы наблюдаются очень редко. Даже несмотря на то что до начала радионуклидной терапии и вместе с радием пациенты могли получать другие варианты лечения, частота НЯ и токсичности не увеличивается.
Еще одно исследование – анализ базы данных FLATIRON. Протокол включил 625 пациентов, которые получали радий-223 с 2013 по 2017 г. Помимо выживаемости оценивали прежде всего частоту симптоматических скелетных событий: патологических переломов, компрессии спинного мозга, необходимость проведения лучевой терапии на область костных метастазов или хирургических вмешательств по поводу костных метастазов. Пациенты также получали гормональные препараты абиратерон и энзалутамид до, после или даже одновременно с радием.
Исследования показали, что при последовательном назначении энзалутамида частота скелетных осложнений увеличивается. Это скорее всего говорит о том, что при одновременном назначении абиратерона и радия именно абиратерон способствует увеличению частоты скелетных осложнений. У пациентов, которые получали сопутствующие остеомодифицирующие препараты, частота возникновения патологических переломов меньше. ОВ в исследовании еще выше – до 30 месяцев и даже больше, поскольку лечение было и комбинированное, и последовательное.
По данным регистра FLATIRON показано, что применение радия-223 возможно и последовательно с антиандрогенными препаратами, и даже в комбинации. И хотя подобная схема на сегодняшний день не рекомендована, частота осложнений при последовательном или даже одномоментном применении радия-223 с абиратероном и энзалутамидом не увеличивается, а применение костно-модифицирующих агентов деносумаба или бисфосфонатов снижает частоту патологических переломов и других осложнений, связанных с метастатическим поражением скелета.
Подводя итог, профессор Алексеев заявил, что четыре крупных исследования, в которых наблюдались пациенты с различными вариантами лечения до и после радиотерапии, а также одновременно с радием-223, показали, что выживаемость больных оказалась не только не хуже, а даже лучше, чем в исследовании III фазы, что подтверждает клиническую эффективность и безопасность препарата Ксофиго® в реальной клинической практике.
Неметастатический кастрационно-резистентный рак предстательной железы (нмкРРПЖ): современные медикаментозные методы лечения и результаты исследования ARAMIS*

доктор медицинских наук, ведущий научный сотрудник урологического отделения НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (Москва)
*Информация содержит данные о не зарегистрированном в РФ препарате.
В докладе М.И. Волковой были освещены современные подходы к лечению нмКРРПЖ и представлены результаты исследования ARAMIS. М.И. Волкова отметила, что пациенты с нмКРРПЖ – особая популяция больных, количество которых возрастает в клинической практике. Это связано с повышением активности радиологов и хирургов в лечении неметастатического гормоночувствительного РПЖ у больных высокого риска прогрессирования, с высоким уровнем ПСА и местнораспространенными опухолями. Закономерно растет частота местных рецидивов. Такие пациенты начинают получать андрогендепривационную терапию, в результате чего за болевание переходит в кастрационно-резистентную фазу.
В настоящее время существует небольшая субпопуляция пациентов, которые не получают радикального лечения по поводу первичного нмРПЖ – им сразу назначается кастрационная терапия, и заболевание постепенно переходит в нмКРРПЖ. Неметастатический КРРПЖ может быть диагностирован у пациента с кастрационным уровнем тестостерона, биохимическим прогрессированием по определению PCWG или AUA и отсутствием метастазов при сцинтиграфии костей и компьютерной томографии (КТ).
Больные нмКРРПЖ – неоднородная группа пациентов. Есть популяция, требующая ранней интенсификации терапии. Это пациенты, у которых время удвоения ПСА 10 месяцев и менее, риск появления метастазов и смерти от прогрессирования РПЖ возрастает более чем в три раза. (М.И. Волкова напомнила, что время удвоения ПСА не рассчитывается путем деления на два – это логарифмическая функция и выводится по специальной формуле или с использованием калькулятора.)
Ранняя интенсификация терапии нмКРРПЖ изучалась в трех крупных рандомизированных исследованиях: SPARTAN, PROSPER и ARAMIS. Каждое включило более 1000 пациентов с неметастатической формой КРРПЖ и временем удвоения ПСА 10 месяцев и менее. Исследования имели одинаковую первичную цель – выживаемость без метастазов. Дизайн исследований также сходен: больных рандомизировали на кастрацию в сочетании с антиандрогенами второго поколения – апалутамидом, энзалутамидом или даролутамидом**, а в группе контроля использовалась кастрация в сочетании с плацебо.
**Препарат не зарегистрирован в РФ.
Все три исследования достигли первичной конечной точки. Таким образом, все три препарата относятся к одной фармакологической группе. Но одинаковы ли они? Могут ли специалисты в разных клинических ситуациях сделать индивидуальный выбор в пользу того или иного антиандрогена второго поколения? М.И. Волкова сообщила, что структура препаратов различается: у энзалутамида и апалутамида ригидное ядро, в то время как ядро даролутамида отличается более высокой полярностью и гибкой структурой, которая мешает его молекуле проникать через биологические мембраны.
В доклинических моделях даролутамид блокировал рост клеток РПЖ за счет связывания с андрогенными рецепторами и ингибирования ядерной транслокации андрогенных рецепторов так же, как энзалутамид и апалутамид.
При этом даролутамид блокирует андрогенные рецепторы дикого типа и мутантные андрогенные рецепторы, в том числе при мутациях, ассоциированных с резистентностью к энзалутамиду и апалутамиду. Кроме того, даролутамид показал гораздо более высокую связывающую способность, чем другие антагонисты андрогенных рецепторов.
Трансактивация андрогенных рецепторов также менее частая при использовании даролутамида в сравнении с энзалутамидом и апалутамидом.
Еще одно отличие даролутамида от других антиандрогенов второго поколения – низкая проникающая способность для гематоэнцефалического барьера. Исследования показали, что соотношение концентрации даролутамида в головном мозге и крови намного меньше, чем у апалутамида и энзалутамида. М.И. Волкова отметила, что проведен метаанализ, цель которого выявление различий в максимальной эффективности андрогенной блокады с антиандрогенами второго поколения (даролутамидом, энзалутамидом и апалутамидом) при нмКРРПЖ. Метаанализ исследований ARAMIS, PROSPER и SPARTAN показал, что назначение антиандрогенов второго поколения по данному показанию достоверно снижает риск метастазирования и смерти по сравнению с плацебо, однако значимых различий в эффективности препаратов внутри группы нет. В ОВ также не зарегистрировано существенных различий.
Частота НЯ на фоне максимальной андрогенной блокады с антиандрогенами второго поколения при нмКРРПЖ во всех трех исследованиях значимо выше в группе исследования, чем в группе контроля, потому что использовались комбинации препаратов. При этом достоверных различий в частоте НЯ всех степеней тяжести при использовании разных антиандрогенов второго поколения не зарегистрировано.
Во всех трех исследованиях частота НЯ 3–4-й степени тяжести также достоверно выше в группе исследования (в группе максимальной андрогенной блокады с включением даролутамида, апалутамида и энзалутамида) по сравнению с группой контроля. Но при сравнительном анализе частоты НЯ 3–4-й степени тяжести, ассоциированных с максимальной андрогенной блокадой с включением антиандрогенов второго поколения, разницы результатов в зависимости от использованного антиандрогена метаанализ не выявил.
Во всех трех исследованиях структура НЯ на фоне антиандрогенов второго поколения, применяющихся вместе с кастрацией при нмКРРПЖ, сходная. Чаще регистрировались усталость, гипертензия, сыпь, диарея. Дальше шли редкие НЯ – снижение веса, артралгия, падения, переломы, головокружение, гипотиреоз и судороги.
Тем не менее индивидуальный профиль токсичности препаратов в отношении частоты НЯ различается. Метаанализ показал, что энзалутамид и апалутамид чаще, чем даролутамид, вызывают развитие усталости, которая крайне редко достигает 3–4-й степени тяжести: 33 и 30% для энзалутамида и апалутамида соответственно по сравнению с 12% для даролутамида в регистрационном исследовании.
Для апалутамида более характерно развитие артериальной гипертензии (АГ), чем для других препаратов из этой группы, – 24,8%, при этом АГ на фоне терапии апалутамидом достигает 3–4-й степени тяжести у 14% больных. Также достаточно специфично для апалутамида появление сыпи, редко достигающей 3-й степени тяжести (у 5% пациентов).
Результаты всех трех регистрационных исследований показали: ранняя терапия нмКРРПЖ с использованием антиандрогенов второго поколения не снижала качество жизни в сравнении с плацебо в сочетании с кастрацией. Исследования использовали опросники FACT-P, и все три препарата (даролутамид, энзалутамид, апалутамид) не приводили к снижению качества жизни при раннем назначении.
М.И. Волкова напомнила, что РПЖ, как правило, болезнь пациентов с тяжелым коморбидным фоном и больные нмКРРПЖ применяют не менее одного препарата для его коррекции. Проблемой современной онкологии стало лекарственное взаимодействие, вызывающее ингибирование или индуцирование клинических субстратов и, как следствие, изменение системного воздействия препарата, влияющее на эффективность или безопасность. На действии препаратов сказывается концентрация, меняющаяся при изменении их абсорбции, распределения и выведения путем разложения или экскреции. При этом основные ферменты, которые участвуют в этих процессах, – цитохромы (прежде всего цитохром 3А4/5) и гликопротеин E.
Лекарственное взаимодействие ингибиторов андрогенных рецепторов с клиническими ингибиторами, индукторами или субстратами способно изменить уровень ингибитора андрогенного рецептора, а также клинического субстрата в плазме, что в свою очередь может увеличить риск НЯ, ассоциированных как с назначением антиандрогенов второго поколения, так и собственно с субстратом. Кроме того, за счет лекарственного взаимодействия снижается активность как антиандрогенов, так и препаратов, применяемых совместно с ними. Из-за специфического лекарственного взаимодействия ингибиторы андрогенных рецепторов нельзя применять с клиническим ингибитором (например, с ингибитором CYP2C8), клиническим индуктором (например, с CYP3А4) и клиническим субстратом (например, с CYP2C9). Но таких межлекарственных взаимодействий немного. Можно ожидать лекарственного взаимодействия при совместном назначении антибиотика рифампицина, применяемого при туберкулезе, с энзалутамидом и даролутамидом.
Кроме того, с осторожностью следует назначать энзалутамид и даролутамид с клиническим индуктором карбамазепином, используемым в качестве противосудорожного средства, что актуально при назначении антиандрогенов второго поколения, которые могут вызывать судороги у больных. Ингибиторы ферментов, потенциально способные взаимодействовать с антиандрогенами второго поколения апалутамидом и энзалутамидом, включают хорошо известные и крайне нежелательные для совместного назначения блокаторы кальциевых каналов дилтиазем и верапамил. Антибиотик кларитромицин нежелательно комбинировать с любыми антиандрогенами второго поколения. Антитромботическое средство клопидогрел – это дезагрегант, который нежелательно комбинировать с энзалутамидом.
Потенциальные лекарственные взаимодействия между субстратами ферментов и антиандрогенами второго поколения являются более серьезной проблемой: широкий спектр блокаторов кальциевых каналов, сердечных гликозидов, ингибиторов протонной помпы, анальгетиков, снотворных, антипсихотиков (включая галоперидол), а также статинов и антитромботических препаратов не следует назначать вместе с апалутамидом и энзалутамидом. Из препаратов-субстратов нежелательный для совместного назначения с даролутамидом – статин розувастатин. Но в РФ в клинической практике чаще используется аторвастатин.
М.И. Волкова подчеркнула, что список препаратов, которые с осторожностью следует назначать вместе с апалутамидом и энзалутамидом, достаточно велик, в то время как даролутамид – препарат, достаточно благоприятный для комбинирования с другими лекарственными средствами, которые применяются для коррекции сопутствующих заболеваний. В список препаратов, нежелательных для комбинации с даролутамидом, входят антибиотики кларитромицин и рифампицин, статин розувастатин и противосудорожный препарат карбамазепин.
Исследование ARAMIS продемонстрировало, что даролутамид – это безопасный препарат для сочетанного применения с терапией других заболеваний. В регистрационном исследовании при нмКРРПЖ пациенты, включенные в исследование ARAMIS, практически в 100% случаев получали один и более дополнительных препаратов.
Чаще всего дополнительно назначались гипотензивные препараты, анальгетики, статины, а также антикоагулянты и дезагреганты. При этом в группах лечения абсолютно сопоставимы частота НЯ, частота редукции доз и частота прекращения терапии. Но ожидаемое взаимодействие осталось только ожидаемым, потому что дополнительный анализ данных пациентов, принимавших статины в исследовании ARAMIS, не показал различий по НЯ между даролутамидом и плацебо. Выступающая напомнила, что изменение подходов к лечению местнораспространенного РПЖ привело к росту частоты неметастатической формы заболевания. Время удвоения ПСА 10 месяцев и менее – фактор риска метастазов и смерти от РПЖ. У пациентов с нмКРРПЖ из группы высокого риска метастазирования и смерти доказана эффективность максимальной андрогенной блокады с включением нестероидных антиандрогенов второго поколения апалутамида, даролутамида и энзалутамида.
Подводя итог выступлению, М.И. Волкова заявила, что даролутамид – это новый высокоаффинный антиандроген второго поколения, он вскоре войдет в отечественную клиническую практику. По данным рандомизированного клинического исследования III фазы ARAMIS, даролутамид снижает риск метастазов и смерти на 59%, что сопоставимо с результатами, которые достигнуты в регистрационных исследованиях апалутамида и энзалутамида. Даролутамид имеет благоприятный профиль безопасности, не ухудшает качество жизни пациентов, позволяет безопасно проводить лечение сопутствующих заболеваний. В заключение симпозиума спикеры подвели его итоги. Успехи в лечении метастатического гормоночувствительного РПЖ увеличили разнообразие популяции пациентов с кастрационно-резистентной формой заболевания.
Пациенты с костными метастазами и больные с неметастатической формой – особая группа пациентов, им необходимо подбирать лечение индивидуально. КРРПЖ с метастазами только в кости – идеальная модель для назначения системной альфа-радиотерапии радием-223, позволяющим увеличить ОВ этой группы больных, а также снизить частоту скелетных осложнений. Раннее назначение системной альфа-радиотерапии до момента появления висцеральных метастазов увеличивает суммарную продолжительность жизни без прогрессирования и общую продолжительность жизни пациентов с КРРПЖ, которые получают последовательную терапию разными препаратами.
Неметастатический КРРПЖ – проблема, с которой специалисты все чаще встречаются в клинической практике. Данный вид заболевания – это показание к назначению максимальной андрогенной блокады нового формата – кастрации в сочетании с антиандрогенами второго поколения (апалутамидом, энзалутамидом и даролутамидом, который не зарегистрирован в РФ). Эти препараты снижают риск метастазирования и смерти, не ухудшая качество жизни пациентов групп высокого риска метастазирования, которые нуждаются в интенсификации лечения.