«Метод иммунотерапии пришел в нашу клиническую практику всерьез и надолго», – так начал выступление на конференции RUSSCO «Иммуноонкология» С.А. Тюляндин, д.м.н., профессор, председатель Российского общества клинической онкологии, заместитель директора по научной работе, заведующий отделением клинической фармакологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Об этом свидетельствует тот энтузиазм, который вызвали первые, с его точки зрения пока что достаточно скромные, успехи в использовании иммунотерапии. Сейчас запущена огромная программа изучения новых препаратов, проводятся клинические исследования в этой области. Обычно, когда приходит новый метод и попадает в руки онкологов, врачи стараются как-то приспособить его к уже стандартным методам лечения. Что касается иммуноонкологии и иммунотерапевтических средств, здесь все происходит наоборот: теперь специалисты пытаются найти место старым привычным методам, применяя их совместно с новыми иммуноонкологическими препаратами. Поэтому, по прогнозам Тюляндина, в течение многих лет иммунотерапия будет одним из самых важных и основных методов в практике онкологов.
За последние годы произошло много событий, которые позволили сделать иммунотерапию более доступной в нашей стране. На недавней конференции по раку легкого я спросил аудиторию, у кого из коллег есть опыт использования современных иммуноонкологических препаратов в рутинной практике, вне рамок клинических исследований. И, к моему удивлению и удовлетворению, практически треть зала подняли руки.
За это время RUSSCO запустило в рамках программы молекулярно-генетического тестирования определение экспрессии PD-L1 на всей территории РФ, и мы будем пользоваться этой программой для выявления более четких показаний для назначения препаратов. Еще один очень важный шаг: иммуноонкологические препараты включены в список жизненно важных препаратов РФ, что сделало их доступными на всей территории нашей страны. Сегодня программа фонда ОМС позволяет использовать эти лекарства в практике.
Что мы узнали:
Я попытаюсь сформулировать то, что мы поняли за 100 лет изучения противоопухолевого иммунитета у наших пациентов. Онкологи теперь четко понимают, что в организме каждого больного происходит борьба со злокачественной опухолью, чаще всего невидимая. Это борьба иммунной системы и опухоли, и она, судя по всему, может быть достаточно успешна на первых этапах развития опухолевого процесса. Но когда пациент оказывается в клинике, это уже свидетельство того, что иммунитет потерпел крах, опухоль ускользает от действия противоопухолевого иммунитета. И только в этом случае она прогрессирует, метастазирует и, увы, приводит к гибели пациента.
Нобелевская премия прошлого года была присуждена за открытие, которое свидетельствует, что в большинстве случаев опухоль использует существующие в каждом из нас нормальные механизмы контроля иммунной системы. Иммунная система строго регулируемая, и излишняя ее активация при отсутствии весомых причин – внешнего или внутреннего врага – губительна, поскольку чревата развитием аутоиммунных заболеваний. Поэтому у каждого человека существует система подавления излишней активности иммунной системы.
Что мы узнали об иммунотерапии?
■ Успешное лечение метастатических опухолей, резистентных к лекарственной терапии
■ Лечение генетических нарушений независимо от локализации первичной опухоли
■ Перспективность использования на ранних стадиях (неоадъювантная и адъювантная терапия)
■ Комбинация с другими методами лечения: лучевая терапия, химиотерапия, таргетная терапия
■ Иммуноопосредованная токсичность
Профессор Дэниел Чен, один из основоположников онкоиммунотерапии, сформулировал, как происходит развитие противоопухолевого иммунитета у человека. Без сомнения, все начинается с опухоли. При ее появлении и росте опухолевые клетки гибнут в результате апоптоза, в кровоток попадают их остатки в виде белков, участков мембран, опухолевой ДНК. Cостав опухолевых клеток в какой-то степени отличается от нормального вследствие большого числа мутаций в опухолевой ДНК и производства белков с несколько иным составом. Иммунная система в лице дендритных клеток должна распознавать эту разницу, считывая опухолевые белки как чужеродные антигены. Дендритная клетка помещает их в рецептор совместимости первого типа и переходит в лимфатический узел, где встречается с Т-лимфоцитом и передает ему информацию о наличии чужеродного антигена. Происходит активация так называемого прайминга, производится целый рой Т-лимфоцитов, направленных против опухолевого антигена. Т-лимфоциты выходят в кровоток, находят опухоль, приходят в нее и реализуют свой противоопухолевый эффект. Опухолевые клетки погибают, вновь выбрасывается антиген, и дендритная клетка может распознавать большее число опухолевых антигенов.
Когда этот круг начинает крутиться, у него есть два важных свойства:
- если противоопухолевый иммунитет начинает работать, то с каждым кругом он раскручивается и становится более мощным, поэтому так важно запустить его;
- если не работает хотя бы одна ступень в этом цикле, то противоопухолевый иммунитет теряет способность уничтожать опухолевые клетки.
Сегодня для мишеней выбраны два очень важных момента в иммунном цикле: момент активации Т-клеток, которая осуществляется дендритами, и конечный момент, когда Т-лимфоциты приходят в опухоль, распознают опухолевые клетки и должны реализовать свой потенциал, уничтожив ее. Если мы говорим о процессе передачи информации, то в этом случае нашим решением служит рецептор CTLH-4, который имеется в ранней Т-клетке. Этот рецептор в случае его активации подает негативный сигнал, в результате чего передача информации о наличии врага прекращается. Это важный момент: если иммунная система уничтожает возбудитель и вирус, а чужеродный белок блокирует, то в принципе иммунная система должна быть выключена. Один из механизмов выключения – механизм передачи информации. Было предположение, что, если мы попытаемся заблокировать негативный сигнал у больных с опухолевым процессом, может быть, процесс распознавания и передачи информации будет более эффективным и таким образом послужит более действенным запуском иммунной системы у наших пациентов. В качестве препаратов разработаны моноклональные антитела – ипилимумаб, который показал, что в принципе у части больных только ипилимумаб может запускать иммунитет и приводить к излечению пациентов.
Второй момент: точкой приложения новых препаратов – ингибиторов контрольных точек иммунного ответа является момент реализации противоопухолевого эффекта уже в опухоли непосредственно, когда цитотоксические Т-лимфоциты входят в опухоль. Казалось бы, раз они пришли в опухоль, можно предполагать, что в принципе они уже получили нужную информацию и распознали врага. Но они вдруг теряют свою способность реализовать противоопухолевый эффект. Одним из механизмов этой потери была определена активация рецептора PD1, рецептора естественной смерти цитотоксических Т-лимфоцитов, вследствие чего теряется способность реализовывать противоопухолевый эффект. В норме это важнейший механизм выключения активности T-лимфоцитов после того, как они уничтожили врага, и предотвращения развития аутоиммунных реакций. В опухоли опухолевые клетки способны продуцировать белок PD-L1, который активирует рецептор PD1 и тем самым препятствует реализации противоопухолевого иммунитета. Были разработаны моноклональные антитела, которые блокируют рецептор PD1 (ниволумаб, пембролизумаб) и его лиганд PD-L1 (атезолизумаб, дурвалумаб).
Что мы узнали, имея достаточно скромный пока опыт введения в клинику этих препаратов (они появились только с 2015–16 гг. в отличие от ипилимумаба, который изучался уже в течение десяти лет)? Мы увидели успешное лечение метастатических опухолей, ранее резистентных к системной терапии. В качестве примера можно взять меланому и немелкоклеточный рак легкого. По результатам исследований CheckMate-067, у больных с диссеминированной меланомой при использовании ниволумаба в качестве первой линии системной терапии трехлетняя выживаемость составила 52%, а комбинация этих двух препаратов дает эффективную трехлетнюю выживаемость 67%. Надо вспомнить, что химиотерапия, которую мы проводили у этих больных, ранее оказывала минимальное влияние на увеличение продолжительности жизни: пятилетняя продолжительность жизни была менее 5%. Сегодня известны пятилетние результаты лечения больных, которые получали иммунотерапию в рамках I фазы. На них отрабатывались режим и дозы препаратов. Для ниволумаба и пембролизумаба пятилетняя выживаемость была на удивление одинакова – 34%, т.е. каждый третий больной с метастатическим процессом, ранее получавший какую-то терапию, живет долго и, дожив до пяти лет, в принципе имеет очень высокий шанс дожить до десяти, а может быть, и более лет. Среди больных, которые прежде не получали лечения, 41% продемонстировал пятилетнюю выживаемость, т.е. 2/5 больных с метастатической меланомой живут пять лет и более без прогрессирования болезни. Фантастические результаты.
Опухоль, которая на протяжении 20 лет никаких особых успехов в лечении не демонстрировала, – это, конечно, рак легкого. В исследование KEYNOTE-024 были включены метастатические больные с немелкоклеточным раком легкого с высокой экспрессией PD-L1 в опухоли. Пембролизумаб продемонстрировал медиану продолжительности жизни 30 месяцев. До этого больные жили всего 8–10 месяцев. Результаты говорят о том, что каждый третий больной немелкоклеточным раком легкого теперь может жить три года без признаков прогрессирования болезни и имеет шансы прожить затем до десяти лет.
Удивительно, но данный метод лечения позволил нам отказаться от органной принадлежности. Мы стали назначать терапию в зависимости от генетических нарушений, потому что для очень многих опухолей характерна микросателлитная нестабильность, вследствие чего в ДНК опухолевой клетки имеется огромное число мутаций. Это позволяет иммунной системе легко распознать опухоль и запустить противоопухолевый иммунитет. Чаще всего микросателлитная нестабильность диагностируется при аденокарциноме матки (30%), гораздо реже при колоректальном раке (6%) и значительно реже во всех других случаях. Но лечение пациентов (12 видов опухолей – остеосаркома, рак простаты, рак тонкой кишки и т.д.) просто фантастическое: двухлетняя выживаемость у 70–75% пациентов.
Другой важный момент. Получив первые положительные результаты у метастатических больных, онкологи стали назначать лекарства на более ранних фазах, включать их в адъювантную и неоадъювантную предоперационную терапию. Сегодня есть результаты лечения больных меланомой 3-й стадии с высоким риском прогрессирования. Ниволумаб и пембролизумаб демонстрируют четкое улучшение результатов лечения и прогноза у больных, поэтому они включены во все рекомендации в качестве важнейшей опции для этой группы пациентов.
Но все не стоит на месте. Появились данные исследования ниволумаба у больных на ранних стадиях операбельного рака легкого. Ниволумаб назначали в два введения с интервалом две недели у больных, которым планировалась операция. У двух больных после введения препарата опухолевых клеток не обнаружено. Еще у шести пациентов 90% опухолевых клеток было убито двумя введениями, в других случаях погибло гораздо меньше. Но очень важный момент: даже если остается опухоль, она меняет свой состав и свойства после двух введений, потому что пришли активированные цитотоксические Т-лимфоциты. И мы можем надеяться, что они уже начали работать и осуществлять противоопухолевый иммунитет, возможно, оказывая системный характер, минимизируя возможность дальнейшего системного прогрессирования, метастазирования этой опухоли.
Новые иммуноонкологические препараты успешно сочетаются с привычными методами лечения: лучевой, таргетной и химиотерапией. В качестве примера приводим данные, что у больных немелкоклеточным раком легкого, у которых имеется невысокая экспрессия PD-L1 (менее 50%), назначение комбинации «химиотерапия + пембролизумаб» приводит к существенному улучшению результатов лечения по сравнению с одной только химиотерапией. Исследование PACIFIC демонстрирует возможность сочетания лучевой терапии у больных немелкоклеточным раком легкого 3-й стадии. Назначение препарата дурвалумаб – ингибитора PD-L1 демонстрирует существенное улучшение результатов химиолучевой терапии. А сочетание пембролизумаба и таргетного препарата акситиниба улучшает результаты лечения по сравнению с сунитинибом в качестве первой линии системной терапии рака почки.
Осторожно: токсичность!
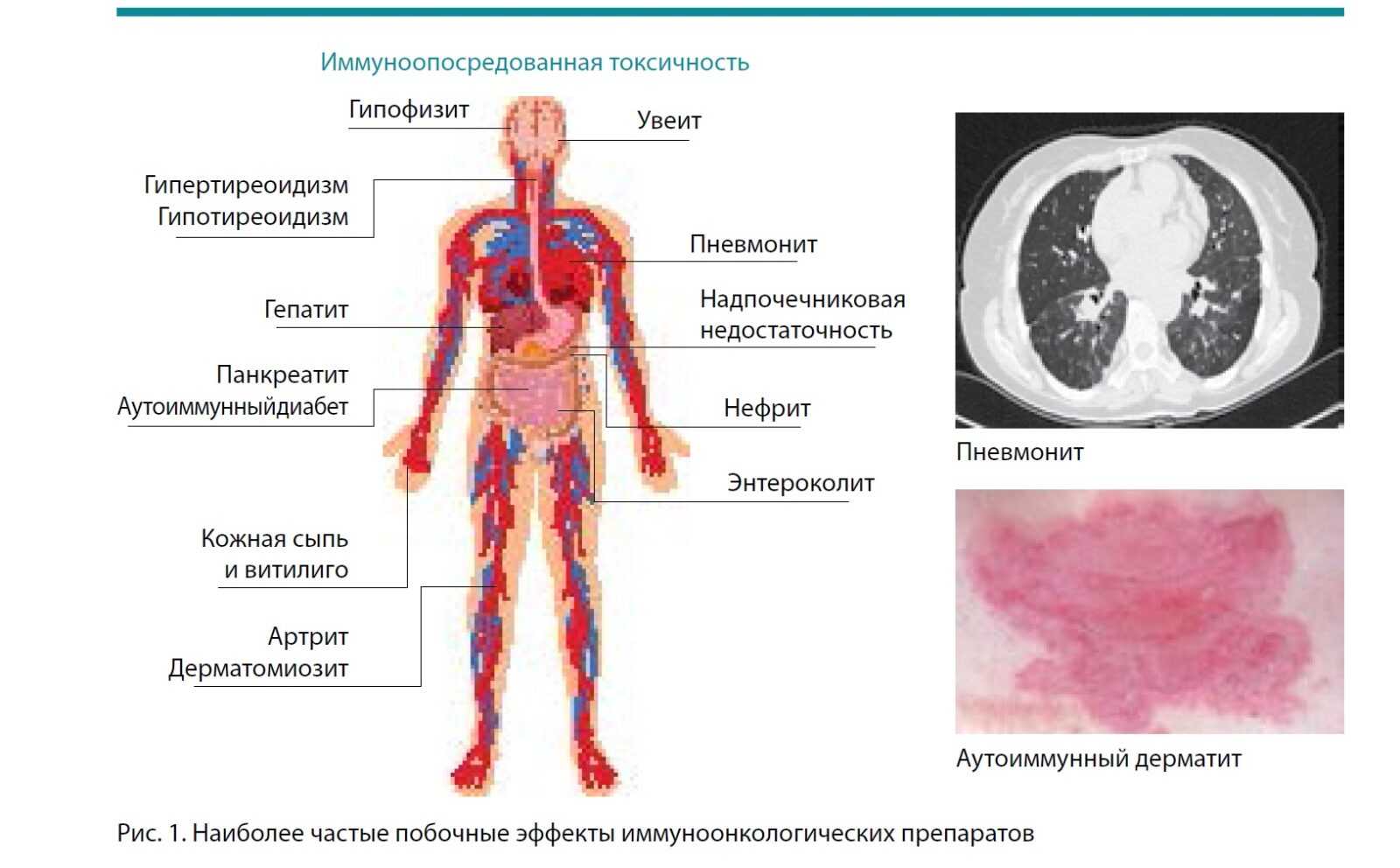
Важно помнить, что данный метод лечения обладает серьезной токсичностью, с которой онкологи прежде никогда не сталкивались и которую плохо распознают. Это аутоиммунные реакции, потому что используются ингибиторы, которые растормаживают иммунитет. Ипилимумаб растормаживает иммунитет очень рано, и все Т-лимфоциты направлены на все антигены, поэтому мы и видим столько побочных эффектов. А препараты ниволумаб, пембролизумаб, к счастью, растормаживают только те лимфоциты, которые направлены на определенный антиген. Таким образом, появляется меньше побочных аутоиммунных реакций, чем при использовании ипилимумаба. Но тем не менее эти реакции могут возникнуть в любой точке нашего организма.
На рисунке 1 представлены наиболее частые побочные эффекты. Без сомнения, очень сильно страдают эндокринная система, гипофиз, щитовидная железа, надпочечники. Побочные эффекты наблюдаются и со стороны других органов – печени, почек, кожи, легких. Поэтому врач должен быть нацелен на распознавание осложнений и понимать, что они связаны с препаратом. Онколог должен назначить на короткое время глюкокортикоиды, которые не влияют на эффективность иммуноонкологических препаратов, но прекрасно купируют осложнения и не дают им развиться. Проблема возникает, если симптомы токсичности распознаются на поздних этапах и приводят к опасным осложнениям.
Препараты ипилимумаб, пембролизумаб и ниволумаб сегодня рекомендованы для огромного числа опухолевых заболеваний. Здесь перечислены, возможно, не все, потому что регистрация показаний происходит практически на постоянной основе (рис. 2). Каждый месяц мы узнаем о добавлении нового показания для использования препаратов. Создается ощущение, что иммуноонкологические препараты не привязаны к какому-то органу и ткани, а по сути носят универсальный характер, поскольку, манипулируя активностью иммунной системы, мы можем добиться активации противоопухолевого иммунитета. Но проблема заключается в том, что сегодня мы умеем делать это лишь у небольшой доли больных – при меланоме, немелкоклеточном раке легкого. При многих других часто встречаемых опухолях эффект гораздо ниже. И наша задача – увеличить количество больных, для которых новый метод лечения будет эффективным.
Но не менее важно уже сегодня определять ту популяцию больных, которые выиграют от лечения иммуноонкологическими препаратами. Для этого мы определяем наличие PD-L1 в опухоли с помощью иммуногистохимического исследования. Если в опухоли содержится этот лиганд при наличии Т-лимфоцитов, мы можем предположить, что именно он является возможным механизмом блокировки иммунного ответа. И тогда назначение моноклональных антител, которые препятствуют выключению противоопухолевой активности T-лимфоцитов с помощью PD-L1/PD1, имеет высокий шанс быть успешным. Но, к сожалению, такая воспаленная опухоль с экспрессией PD-L1 встречается лишь у 25–30% больных. У большинства пациентов мы видим другую картину: одиночные иммунные клетки в опухоли, которые не вызывают никакого противоопухолевого эффекта. Или же мы видим их концентрацию в виде вала на границе опухоли, словно она не пускает эти клетки внутрь для реализации противоопухолевого эффекта. И наконец, так называемая иммунологическая пустыня – случаи, когда вообще отсутствуют признаки иммунного ответа. Нам предстоит научиться, как у группы больных с отсутствием противоопухолевого иммунитета стимулировать его развитие.
Как сделать терапию эффективнее?
Очень важно понять механизмы чувствительности и резистентности опухоли к иммунотерапии. Зная их, мы сможем добиться лучшей селекции пациентов. Мы будем знать, каким больным назначать иммунотерапию и как.
Другое свойство, которое мы только сейчас начали понимать, – это иммуногенность опухоли. О ней можно судить по мутационной нагрузке, т.е. по числу тех мутаций, которые имеются в опухоли. Чем больше мутаций, чем больше различий между нормальной и опухолевой клетками, тем легче иммунной системе распознать их и реализовать свой эффект. Но вместе с тем мы поняли, что не все антигены в равной степени способны индуцировать противоопухолевый иммунитет. Сегодня развивается уникальное направление, когда в результате секвенирования следующего поколения мы определяем все мутации опухолевой клетки. Затем на основании этой мутации конструируются белки, которые мутированные гены производят, и, наконец, происходит моделирование, как эти мутированные белки могут быть распознаны этим рецептором первого типа. Таким образом, идет отбор наиболее вредоносных антигенов, которые способны индуцировать противоопухолевый ответ. Важный момент – просто оценить, насколько опухоль антигенная и насколько иммунная система может реагировать на нее. Эта реакция может быть одним из критериев отбора в будущем. Отбирая самые антигенные антигены, мы будем конструировать уже более эффективные вакцины или можем конструировать клетки Т-лимфоцитов.
Во многом активность иммунной системы, Т-лимфоцитов, способность опухоли защищать себя зависят от тех сигнальных путей, которые отвечают за реализацию противоопухолевого иммунитета. И знание их также очень важно, они в основном ответственны за механизмы резистентности. Нам нужны новые мишени. В этом качестве в первую очередь мы должны рассматривать строму, потому что сегодня она определяет агрессивность опухоли и возможность ее уйти от иммунного ответа. В противоопухолевом иммунном ответе задействовано огромное число клеток иммунной системы, одни работают как супрессоры, другие – как активаторы, способствуя реализации противоопухолевого иммунитета. Их соотношение, взаимодействие друг с другом пока остается тайной для нас.
Нельзя не учитывать системные факторы. Оказывается, особая роль принадлежит микробиоте, бактериальному содержимому нашего кишечника. Нарушение микробиоты, например при использовании антибиотиков, приводит к существенному снижению эффективности иммунотерапии.
Все это позволит нам сделать противоопухолевую иммунотерапию грозным и эффективным оружием.