Клиническая дискуссия на эту тему состоялась на Российском международном симпозиуме «Рак почки» в Санкт-Петербурге в июле этого года. Специалисты разбирались, какие препараты наиболее действенны в терапии светлоклеточного метастатического рака почки и как верно отбирать кандидатов из числа пациентов на подобное лечение.
Выбор лекарственной терапии для последующих линий лечения при метастатическом почечно-клеточном раке
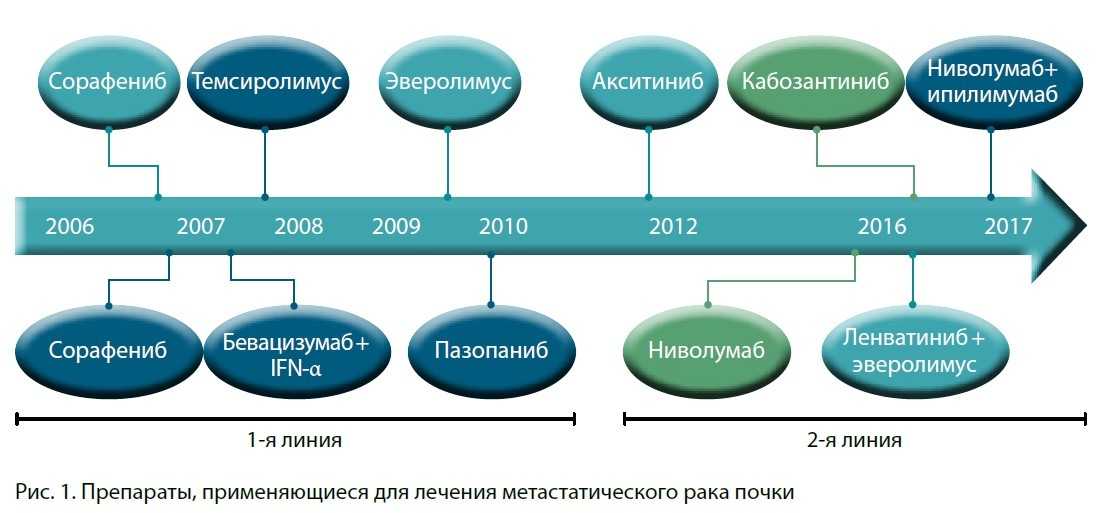
Существует большое число препаратов, которые можно использовать у больных с метастатическим почечно-клеточным раком. На слайде они представлены в хронологическом порядке в зависимости от сроков регистрации (рис. 1).
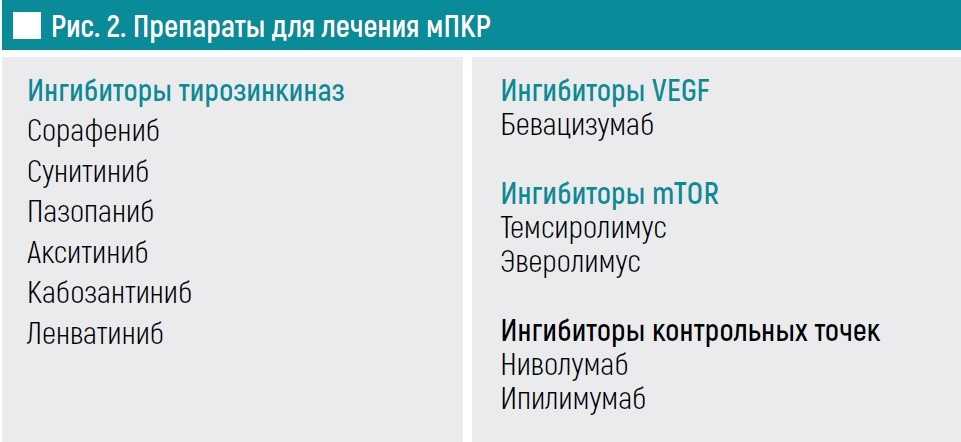
На синем фоне – препараты, которые применяются в первой линии, на голубом – во второй. Есть препараты, которые могут быть использованы как для второй, так и для первой линии. Это таргетные препараты, которые относятся к классу ингибиторов ангиогенеза. Отдельная категория – это иммуноонкологические препараты (рис. 2).
При таком разнообразии не всегда бывает понятно, как выбирать и назначать тот или иной препарат. Если мы посмотрим на стандарты выбора терапии, то увидим, что ранее для первой линии предлагали таргетные препараты, для второй – таргетную и иммунотерапию (табл. 1). 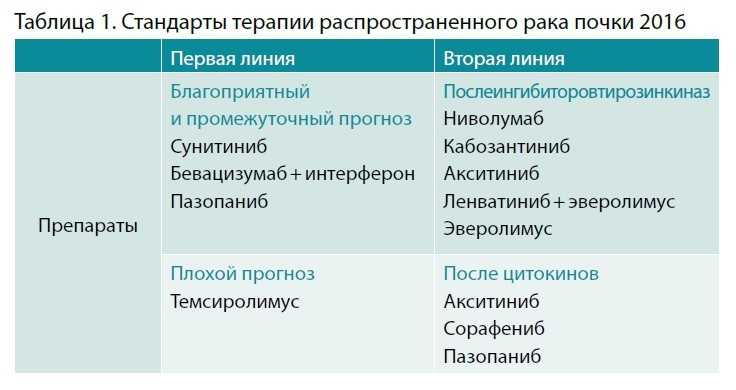
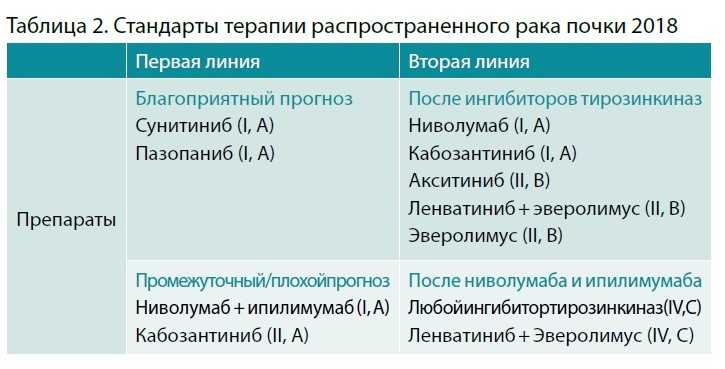
Сейчас алгоритм изменился, и мы уже в первой линии имеем возможность назначать иммунотерапию, хотя таргетная терапия по-прежнему остается актуальной. Во второй линии лечения, на которой мы с вами сейчас и сосредоточимся, стандарты терапии не поменялись, это все те же пять вариантов терапии – ниволумаб, кабозантиниб, акситиниб, эверолимус и комбинация препаратов ленватиниб и эверолимус (табл. 2).
Какие критерии мы можем использовать для выбора препарата во второй линии терапии? Прежде всего необходимо учитывать механизм действия препарата, который использовался в первой линии, – таргетный или иммунный препарат. Во-вторых, важно принимать во внимание эффективность первой линии лечения, какой ответ был получен, какова была длительность эффекта, скорость прогрессии, переносимость, профиль нежелательных явлений в первой линии.
Возникают вопросы: надо или нет определять и учитывать прогноз заболевания при выборе препарата для второй линии? Надо ли оценивать соматический статус больного и статус опухоли (объем, локализацию метастатических очагов)? И наконец, надо ли ориентироваться на профиль возможной токсичности препаратов второй линии?
Какие препараты и почему были зарегистрированы для использования во второй линии терапии? Первым таргетным препаратом был эверолимус, эффективность которого сравнивалась с плацебо при назначении во второй и последующих линиях. Эверолимус показал преимущество по показателю выживаемости без прогрессирования, разница с плацебо составила три месяца, различий по показателю общей выживаемости получено не было. Сегодня в большинстве клинических рекомендаций эверолимус уже не рассматривается в качестве возможного варианта лечения во второй линии терапии.
Следующим зарегистрированным препаратом стал акситиниб. Его сравнивали уже не с плацебо, а с сорафенибом и применяли во второй линии как после сунитиниба, ингибитора ангиогенеза, так и после цитокинов. Оказалось, что акситиниб достоверно превосходит сорафениб по показателю выживаемости без прогрессирования. Но опять же за счет назначения пациентам последующих линий терапии акситиниб не продемонстрировал увеличения общей выживаемости.
Следующая опция – это уже иммуноонкологический препарат ниволумаб, который в регистрационном исследовании сравнивался с эверолимусом во второй линии лечения. Было продемонстрировано, что ниволумаб не увеличивает выживаемость без прогрессирования по сравнению с эверолимусом, но при этом достоверно увеличивает общую выживаемость, что послужило основанием для его регистрации.
И наконец, кабозантиниб – четвертый препарат, который был зарегистрирован в режиме монотерапии для применения во второй линии лечения, относится к таргетным ингибиторам ангиогенеза широкого спектра. Кабозантиниб также сравнивался с эверолимусом как со стандартом второй линии, продемонстрировав увеличение как беспрогрессивной, так и общей выживаемости.
Но на сегодняшний день кроме монотерапии во второй линии может назначаться уникальная комбинация двух таргетных препаратов – эверолимуса, хорошо нам известного, и ленватиниба, который на данный момент является одним из самых мощных ингибиторов тирозинкиназ, блокируя помимо рецепторов VEGFR также рецепторы фактора роста фибробластов. Скорее всего именно поэтому ленватиниб позволяет преодолеть резистентность к классическим анти-VEGFR-препаратам; при этом эверолимус добавляет эффективности за счет преодоления резистентности и отсечения пути, связанного с молекулой mTOR.
Такое комбинированное воздействие клинически проявляется высокой активностью комбинации, которая была продемонстрирована в Исследовании 205 с включением больных с прогрессированием заболевания, уже получивших терапию первой линии ингибиторами VEGFR. В Исследовании 205 пациентов рандомизировали на три группы: монотерапия ленватинибом, монотерапия эверолимусом и группа комбинированной терапии ленватинибом и эверолимусом. Это было исследование II фазы, оно включало не очень большое количество больных, но комбинация препаратов продемонстрировала совершенно уникальные показатели беспрогрессивной выживаемости: медиана составила 14,6 месяца. Даже в первой линии терапии ни один таргетный препарат не показывал таких результатов – комбинация почти в три раза превышала эффективность эверолимуса по данному показателю.
Наибольший выигрыш был получен в подгруппе пациентов с хорошим прогнозом, медиана выживаемости без прогрессирования составила 20 месяцев, и в подгруппе пациентов промежуточного прогноза – 14,6 месяца. В группе неблагоприятного прогноза комбинация не давала статистически достоверного преимущества.
Анализ выживаемости без прогрессирования в зависимости от локализации метастазов показал, что у больных с метастазами в костях и печени комбинация не давала преимуществ, но у пациентов с метастазами в лимфоузлах, легких и внутренних органах было достигнуто достоверное преимущество по сравнению с монотерапией эверолимусом. И что очень важно, у больных с суммой диаметров опухолевых очагов больше 7,4 см комбинация работала лучше, чем у больных с меньшей опухолевой нагрузкой. Получается, что, чем больше была опухолевая нагрузка, тем более выражен результат. По уровню объективных ответов, полных и частичных регрессий были получены следующие результаты: 43% в группе терапии комбинацией препаратов (из них 2% полных ответов) и только 6% объективных ответов в группе терапии эверолимусом.
По показателю общей выживаемости комбинация ленватиниба с эверолимусом продемонстрировала значимое увеличение в общей группе пациентов – до 25,5 месяца.
Если попытаться провести непрямое сравнение препаратов на основании результатов, полученных в исследованиях во второй линии терапии у больных с метастатическим раком почки, то можно отметить, что кабозантиниб и ниволумаб по частоте объективных ответов работают примерно одинаково (17 и 25% соответственно). Последний даже несколько лучше. Но наибольший показатель объективного ответа был продемонстрирован в группе терапии «ленватиниб + эверолимус» (43%). В отношении медианы выживаемости без прогрессирования таргетные препараты и ниволумаб работают также примерно одинаково (акситиниб – 4,8 месяца, эверолимус – 4,9, ниволумаб – 4,6 месяца, чуть лучше показатель у кабозантиниба – 7,4 месяца). И опять же в два раза лучше работает комбинация «ленватиниб + эверолимус» (14,6 месяца). В отношении медианы общей выживаемости наибольшие показатели были получены для комбинации «ленватиниб + эверолимус» и ниволумаба (25,5 и 25 месяцев соответственно), чуть ниже – для кабозантиниба (21,4 месяца), хуже – для таргетных препаратов акситиниб (16,5 месяца) и эверолимус (14,8 месяца).
Более корректным является сравнение препаратов в рамках метаанализов. По данным одного из них, опубликованного в 2017 г., комбинация ленватиниба с эверолимусом была признана наиболее эффективным вариантом терапии второй линии метастатического почечно-клеточного рака по показателю выживаемости без прогрессирования, снижая риск прогрессирования заболевания или смерти на 60% по сравнению с эверолимусом.
Обсуждение клинического случая: опыт лечения пациента с быстрым прогрессированием
 Роман Валерьевич Смирнов,
Роман Валерьевич Смирнов,
отделение онкоурологии Вологодского областного онкологического диспансера
Пациентка, 59 лет. Рак правой почки T2N0M0. В июне 2016 г. выполнена МСКТ брюшной полости и легких. Метастазов в легких не выявлено, в печени обнаружены четыре гемангиомы, в нижнем полюсе правой почки – патологическое образование 9,7 × 9 × 8,7 см, деформирующее наружный контур, с признаками прорастания в паранефрий и чашечно-лоханочную систему, накапливающее контрастный препарат, с очагами некроза в центре. При остеосцинтиграфии данных о наличии метастазов не получено. По данным ПЭТ-КТ печени с мечеными эритроцитами выявлены признаки гемангиомы печени.
Далее пациентка получала лечение в ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика A.M. Гранова» (РНЦРХТ), Санкт-Петербург. В июне 2016 г. выполнена ангиография, механическая эмболизация правой почечной артерии. Спустя три месяца сделана лапаротомия, нефрадреналэктомия справа. По данным гистологического исследования: светлоклеточный почечно-клеточный рак почки без инвазии в почечный синус. При проведении очередного контрольного обследования в апреле 2017 г., по данным СКТ легких, выявлены очаги в легких: справа в S6 не менее трех очагов, в S10 два очага по 9 мм и на медиальной поверхности 5 мм. Пациентке назначена первая линия таргетной терапии сунитинибом в стандартной дозе 50 мг/сут. Через два месяца от начала приема зафиксировано прогрессирование в виде увеличения размеров таргетных очагов (по данным КТ).
В S10 два очага диаметром 1,2 см, в S3 справа очаг диаметром 0,9 см, прилежащий к медиастинальной плевре. По рекомендации РНЦРХТ была назначена вторая линия терапии – сорафениб 400 мг два раза в сутки. Через два месяца от начала приема сорафениба, по данным КТ, сохраняются множественные очаги в легких, увеличение размеров таргетных очагов; через пять месяцев от начала приема сорафениба – появление новых очагов в легких и увеличение старых. Прогрессирование заболевания.
В следующей линии таргетной терапии назначен ленватиниб 18 мг/сут в комбинации с эверолимусом 5 мг/сут (в связи с отсутствием дозировки 5 мг пациентка получала эверолимус в дозе 10 мг через день). Через три месяца выполнена редукция дозы ленватиниба до 14 мг/сут по причине развития нежелательных явлений (диарея, общая слабость). По данным КТ, через пять месяцев терапии ленватинибом в комбинации с эверолимусом зарегистрировано синхронное уменьшение контрольных очагов в легких. Переносимость лечения удовлетворительная.
По данным КТ, через 10 месяцев от начала приема комбинации – положительная динамика в виде уменьшения размеров контрольных очагов. Терапия продолжена.
По данным КТ, через 15 месяцев терапии комбинацией – уменьшение размеров контрольных очагов (в S10 с 2,3 см до 1,3 см, в S3 справа с 2,9 см до 1,8 см и в S3 слева с 1,5 см до 1,2 см). Терапия продолжена, переносимость удовлетворительная.
Через 20 месяцев терапии комбинацией, по данным КТ, в правом легком определялось незначительное увеличение очагов в S10, S3, S2. На приеме выяснилось, что пациентка решила самостоятельно изменить дозировку эверолимуса и последние два месяца делила таблетку 10 мг, принимая по половине в день.
С пациенткой проведена беседа, лечение продолжено по схеме: ленватиниб 14 мг, эверолимус 10 мг, через день.
Вопрос для обсуждения: какова тактика ведения данной пациентки? Возможна ли эскалация дозы ленватиниба до 18 мг, учитывая хорошую переносимость терапии?
Комментарий профессора Б.Я. Алексеева: «Ситуация, которая произошла с пациенткой, достаточно типичная. У больных, которые плохо отвечают на лечение, после стабилизации или даже прогрессии на сунитинибе переключение на комбинацию „ленватиниб + эверолимус“ позволяет добиться хорошего ответа за счет блокады сигнальных путей, в частности VEGF и mTOR. При прогрессировании на ингибиторах VEGFR обосновано назначение либо ниволумаба, либо комбинации, которая может работать не хуже последнего, особенно у пациентов группы благоприятного прогноза, что и было продемонстрировано в данном клиническом случае.
По данным контрольного обследования незначительное увеличение таргетных очагов не расценивается на данный момент как прогрессирование заболевания, лечение комбинацией может быть продолжено в том же режиме. Увеличение дозы ленватиниба после ее редукции по причине развития нежелательных явлений не рекомендовано инструкцией, в данном случае может быть весьма опасно».
Обсуждение клинического случая: опыт лечения пациента с длительным ответом на терапию ингибиторами тирозинкиназ
 Алексей Сергеевич Калпинский,
Алексей Сергеевич Калпинский,
к.м.н., старший научный сотрудник отделения онкоурологии ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России
Мужчина, 40 лет, в 2014 г. обратился с жалобами на боли в животе. При обследовании выявлена опухоль правой почки 8,2 × 8,7 × 7,1 см, c прорастанием в клетчатку, тромб 6 см в нижней полой вене (НПВ). В сентябре 2014 г. выполнена нефрадреналэктомия справа, тромбэктомия из НПВ. При гистологическом исследовании: светлоклеточный почечно-клеточный рак с выходом за пределы капсулы. Диагноз – рак правой почки 3-й стадии рТ3сN0M0.
Через год – прогрессирование, появились метастазы в правой доле печени, по поводу чего проведено хирургическое лечение – гемигепатэктомия с резекцией диафрагмы и резекцией НПВ (гистология: метастазы светлоклеточного рака). Дальнейшее прогрессирование в январе 2016 г.: метастазы в печени S3, по поводу чего в марте 2016 г. выполнена чрескожная радиочастотная термоабляция.
Пациент оставлен под наблюдением, прогрессирование заболевания через пять месяцев (метастазы по плевре). Прогноз по шкале MSKCC благоприятный, рекомендована таргетная терапия сунитинибом. Длительность терапии – 18 месяцев, наилучший ответ – стабилизация. Нежелательные явления: диарея 1-й степени, артериальная гипертензия 2-й степени, сыпь 1-й степени, ладонно-подошвенный синдром 1-й степени, изменение цвета волос. Прогрессирование процесса в феврале 2018 г.: метастазы в печени, плевре, легких, забрюшинных лимфатических узлах диафрагмы.
Рекомендована смена режима. В качестве возможных опций для второй линии терапии в данном случае рассматривались ниволумаб и комбинация «ленватиниб + эверолимус». Ниволумаб лучше работает у пациентов группы неблагоприятного прогноза, в случае благоприятного прогноза приоритетным является назначение комбинации. В данном случае принимались также во внимание хорошая переносимость ингибитора тирозинкиназ в первой линии лечения, при этом быстрое прогрессирование с массивным появлением новых опухолевых очагов, большой объем опухолевой массы (с поражением лимфатических узлов, фиксировались метастазы в ложе почки). В апреле 2018 г. назначена комбинация «ленватиниб + эверолимус».
Переносимость терапии удовлетворительная, нежелательные явления контролируемы: слабость 1-й степени, диарея 1-й степени, артериальная гипертензия 2-й степени, сыпь 1-й степени, ладонно-подошвенный синдром 1-й степени, стоматит 1-й степени. При оценке эффекта отмечено выраженное уменьшение таргетных очагов. По данным контрольного обследования в июне 2019 г.: уменьшение очага в печени (с 4,5 до 2,5 см), выраженное уменьшение плевральных очагов. В настоящее время длительность терапии комбинацией составляет 15 месяцев, суммарное уменьшение таргетных очагов – 28% , пациент продолжает лечение.
Профессор Б.Я. Алексеев прокомментировал клинический случай: «Я думаю, что этот пример наглядно демонстрирует возможности комбинации у больных, которые получали в первой линии ингибиторы тирозинкиназ с достаточно длительным эффектом. Действительно, у подобных пациентов можно ожидать эффекта от разных препаратов этого класса и во второй линии. Но учитывая, что ленватиниб блокирует не только рецепторы VEGF, но и FGF, есть вероятность, что клинический эффект при назначении комбинации может быть более продолжительным, что было продемонстрировано в данном клиническом случае.
Однако обращаю ваше внимание, что у данного больного были показания для такого лечения. Очень важно перед второй линией терапии оценить прогноз заболевания. При благоприятном прогнозе на фоне длительного ответа в первой линии комбинация ленватиниба с эверолимусом должна работать очень хорошо».
А вот мнение профессора М.И. Волковой, доктора медицинских наук, отделение урологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России: «Этот пациент, на мой взгляд, идеальный кандидат на терапию комбинацией: благоприятный прогноз, быстрое прогрессирование, множественные очаги в более чем одном органе. Необходимо также принимать во внимание наличие метастазов по диафрагме и по плевре, которые, как вы знаете, сложно поддаются терапии. Я бы этому пациенту однозначно назначила комбинацию».
Б.Я. Алексеев дополнил разбор клинического случая: «Комбинация ленватиниба с эверолимусом хороша тем, что она действительно позволяет рассчитывать на быстрый клинический эффект и может иметь преимущества перед другими методами лечения, когда важно добиться уменьшения опухолевых очагов».
Эффективность и переносимость комбинированной таргетной терапии в условиях реальной клинической практики: анализ клинического опыта применения ленватиниба в комбинации с эверолимусом при диссеминированном почечно-клеточном раке
 Мария Игоревна Волкова,
Мария Игоревна Волкова,
д.м.н., профессор, отделение урологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
На сегодня мы располагаем данными лечения комбинированной таргетной терапией 54 пациентов. Мы сопоставляем наших пациентов по выборке с группой Исследования 205, но есть существенные различия по характеристикам.
Закономерно, что в потоке российских пациентов доминировали мужчины среднего возраста, около 16% пациентов имели плохой соматический статус, среди пациентов доминировали больные со светлоклеточным вариантом почечно-клеточного рака, но были и несветлоклеточные опухоли. 80% пациентов имели в анамнезе гипертонию. У 30% больных удаляли метастазы в связи с тем, что это были солитарные опухолевые очаги или паллиативные (речь идет о симптоматическом лечении). 60% пациентов имели синхронные метастазы, в большинстве случаев они были множественные, поражали более чем один орган.
В большинстве случаев метастазы локализовались в легких и костях. Метастазы в печени – классическая неблагоприятная локализация – были более чем у трети больных. Лимфоузлы поражены у большинства пациентов. Приблизительно у 10% больных регистрировался метастатический плеврит, у трех пациентов – метастазы в головном мозге. Достаточно большое количество больных с местными рецидивами, которые по своей этиологии напоминают первичную опухоль и достаточно неохотно отвечают на системную противоопухолевую терапию.
Закономерно, что в нашей популяции доминировали пациенты с промежуточным и хорошим прогнозом. Плохой прогноз по IMDC был у 11% пациентов.
Во второй линии лечения комбинированную таргетную терапию ленватинибом в комбинации с эверолимусом получила только треть больных. Остальные пациенты – две и более линий предшествующей терапии, причем в 15% случаев комбинация назначалась в пятой и более поздних линиях. Все пациенты получили в анамнезе таргетную терапию анти-VEGF, 30% – ингибитор анти-mTOR (на мой взгляд, это достаточно важно, потому что в регистрационные исследования такие больные не включались), и 15% больных успели получить ниволумаб.
Ответ на предшествующее лечение в большинстве случаев заключался в стабилизации опухолевого процесса. Продолжительность первой и второй линий терапии соответствовала регистрационным исследованиям и составляла порядка 11 месяцев. Все случаи предшествующего лечения отменяли из-за прогрессирования опухолевого процесса, у трех больных – по причине развития непереносимой токсичности.
К моменту анализа данных лечение продолжает половина пациентов, завершение терапии из-за прогрессирования произошло в 40% случаев, непереносимая токсичность стала причиной отмены комбинации у двух пациентов, четыре пациента погибли. На данный момент медиана продолжительности завершенной комбинированной таргетной терапии составляет 11 месяцев, что несколько больше, чем в регистрационном исследовании.
Редукция дозы эверолимуса не потребовалась ни в одном случае. Редукция дозы ленватиниба была осуществлена у трети больных: на один шаг – у 17 пациентов и на два – у одного больного, который закончил терапию в дозе 10 мг/сут. Перерыв в терапии ленватинибом потребовался в трети случаев, в четверти случаев у больных с нежелательными явлениями 3-й степени тяжести или индивидуальной непереносимостью нежелательных явлений 2-й степени тяжести. Три пациента на период проведения радиохирургического лечения метастазов в головной мозг прерывали лечение ленватинибом; один пациент прерывал терапию в связи с обострением хронического холецистита, когда предполагали, что ему потребуется хирургическое лечение. Перерыв в терапии эверолимусом в течение пяти суток был необходим в одном случае при плохой индивидуальной переносимости стоматита. Отмена терапии из-за токсичности потребовалась у двух больных.
По спектру нежелательных явлений никаких находок по сравнению с регистрационным исследованием мы не сделали. Нежелательные явления были зарегистрированы у 72% пациентов, вошедших в наше исследование. Нежелательные явления 3–4-й степени тяжести – у 12% больных. Наиболее распространенными являлись диарея (достигала 3–4-й степени тяжести), снижение массы тела, артериальная гипертензия и гипотиреоз. Среди лабораторных отклонений обращает на себя внимание высокая частота анемии всех степеней тяжести (13%). Она достигла 3–4-й степени тяжести у трех больных. Гипергликемия была зарегистрирована у одного пациента. Метаболический синдром при гипергликемии и гиперхолестеринемии выявлен приблизительно у 10% пациентов. Увеличение уровня трансаминаз имело место у 11% больных и достигло 3–4-й степени тяжести в одном случае.
Единственным нежелательным явлением 5-й степени тяжести являлось развитие m-TOR-ассоциированного пульмонита на фоне выраженного эффекта комбинированной таргетной терапии у пациента, имевшего в качестве сопутствующего заболевания аутоиммунную панцитопению и длительное время применявшего кортикостероиды.
Мы проанализировали факторы, которые потенциально могли повлиять на профиль безопасности комбинированной таргетной терапии. Единственным фактором, который был связан с повышением риска редукции дозы, являлся возраст: чем старше был больной, тем выше была вероятность того, что потребуется редукция дозы одного препарата. Не было обнаружено факторов, которые могли бы повлиять на риск прерывания терапии и развития любых нежелательных явлений, в том числе серьезных и тяжелых.
По критериям RECIST максимальный ответ на лечение был распознан как частичный у трех пациентов, у большинства больных была отмечена стабилизация опухолевого процесса, у трех больных зафиксировано прогрессирование. Таким образом, контроль над опухолью был достигнут у 94% больных, однако частота объективных ответов оказалась гораздо ниже, чем мы ожидали, – 5,5%. Медиана времени до развития ответа составила два месяца (на основании данных МРТ). Однако надо отметить, что у пациентов, которые приходили на визиты чаще, эффект регистрировался уже через считанные дни после старта таргетной комбинированной терапии. Медиана уменьшения измеряемых очагов составила 17% (колебалась от 3 до 40%). При этом у всех больных с висцеральными метастазами отмечено появление очагов распада и снижение интенсивности контрастирования, что не учитывается критериями оценки эффекта RECIST.
Особенностями ответа на лечение со стороны неизмеряемых очагов являлось то, что у пяти из семи пациентов с метастатическим плевритом отмечено значительное уменьшение объема или полное исчезновение выпота. При наличии мягкотканных компонентов в метастазах в позвонки он исчезал у всех пациентов. И при перибронхиальном инфильтративном росте метастазов рака почки (крайне неблагоприятная в функциональном отношении локализация для метастазов, поскольку она приводит к уменьшению диаметра бронхов, иногда вплоть до полного отказа легкого) у двух пациентов со сдавлением левого и правого главных бронхов было отмечено увеличение диаметра бронхов в течение первого визита после старта терапии с восстановлением воздушности легочной ткани.
Медиана общей выживаемости в популяции российских пациентов составила 19 месяцев, что несколько ниже, чем в регистрационном исследовании. Медиана беспрогрессивной выживаемости тем не менее была высокой и составила 17,5 месяца.
Фактором риска общей выживаемости, имевшим независимую прогностическую значимость, являлся соматический статус на момент старта терапии. Больные, которые начинают комбинированную таргетную терапию при ECOG 0–1, имеют гораздо большие шансы на увеличение продолжительности жизни. Также более высокие показатели общей выживаемости имели пациенты с удаленной первичной опухолью (до старта терапии). Но здесь нужно четко понимать причинно-следственные связи. Не обязательно, что сама опухоль почки оказывала неблагоприятное воздействие на общую выживаемость, скорее просто операция не выполнялась более тяжелым больным. И, что приятно, наши данные совпадают с данными регистрационного исследования в отношении влияния группы прогноза IMDC на прогноз общей выживаемости. Пациенты, относившиеся к группам хорошего и промежуточного прогноза, имели достаточно высокую медиану общей выживаемости. При достаточно небольшом сроке наблюдения за нашими пациентами в группе хорошего прогноза медиана не была достигнута, в группе промежуточного – составила 16 месяцев, в группе плохого прогноза – три месяца, что подчеркивает необходимость дифференцированного подхода к выбору тактики лечения.
Интересно, что число линий предшествующей терапии (одна или больше), редукция дозы и перерывы в лечении, а также развитие нежелательных явлений 3–4-й степени тяжести не оказывали значимого влияния на общую выживаемость.
В заключение симпозиума Б.Я. Алексеев сказал пару слов о перспективах ленватиниба: «Препарат сейчас активно изучается в различных протоколах клинических исследований, в частности сравниваются два дозовых режима ленватиниба в рамках комбинации „ленватиниб + эверолимус“: 18 мг и 14 мг. На практике мы видим, что доза 14 мг переносится больными значительно лучше. Проводится изучение комбинации при несветлоклеточном раке почки. Исследования ленватиниба в комбинации с пембролизумабом ведутся как при раке почки, так и при других видах злокачественных новообразований: раке эндометрия, немелкоклеточном раке легкого, раке печени, раке мочевого пузыря. В ближайшее время планируется регистрация новых показаний для ленватиниба».